ESPECTROSCOPIA APLICADA INSTRUMENTAÇÃO ANALÍTICA
Em
outra postagem nós abordamos a técnica relacionado com a cromatografia à gás, utilizada nas analises online e desta vez
o nosso objetivo é apresentar uma outra técnica que é a “Espectroscopia”,
aplicada na identificação de dados “fisico-quimico”, obtida
através da transmissão, absorção ou reflexão da energia radiante projetada em
uma amostra.
O que é Espectroscopia?
O termo "espectroscopia"
define as técnicas que utilizam radiação para se obter informação sobre a
estrutura e as propriedades da matéria. O princípio básico partilhado por todas
as técnicas espectroscópicas se resume basicamente em um feixe de radiação
electro magnética direcionado para uma determinada amostra e na
sequência observar como a amostra se comporta a um determinado estímulo. A
resposta obtida é normalmente é registrada como uma função do comprimento de onda da
radiação, em função do comprimento de onda, sendo conhecido como um espectro.
Nesta postagem apresentamos uma visão geral das técnicas espectroscópicas
mais usadas e não apenas as técnicas que utilizam luz ultra violeta ou
visível como o estímulo primário.
O nosso objetivo nesta postagem é nos concentrarmos
em descrever os princípios e principais aplicações das técnicas, mantendo-se as
discussões sobre detalhes técnicos.
O princípio básico partilhado por todas as técnicas espectroscópicas é um feixe de radiação eletro magnética direcionado para uma amostra e observar como a amostra responde a um tal estímulo. A resposta obtida é normalmente gravada como uma função do comprimento de onda da radiação.
Um gráfico da resposta em função do comprimento de onda é conhecido como um espectro.
A técnica da “Espectroscopia” é atualmente largamente aplicada nos analisadores do tipo online, para analise de gases e líquidos ;
a) Espectrometro por Infra-Vermelho
b) Espectrometro por Ultra-Violeta
c) Espectrometro de Massa
d) Espectrometro de Raman
Introdução:
Vários
componentes tem como caracteristica absorver a luz ultra violeta (UV) ou luz visível (Vis.) O diagrama abaixo mostra um feixe de radiação
monocromatica de uma fonte radiativa P0, direcionada a uma amostra. A absorção ocorre quando o feixe de
radiação que atravessa a amostra tem potência radiante P.
|
A equação,
A = 2 - log10 %T , vale lembrar pois permite
calcular de forma simples a “absorção” de dados de transmitância
porcentual.
Resumindo,
se toda a luz que passa através de uma amostra não é absorvida a absorvância
é igual a “zero” e a transmitância percentual é de 100%. Se
toda a luz for integralmente absorvida, a transmitância percentual é igual a
zero e a absorção é infinita.
Lei de Beer-Lambert:
Agora vamos nos atentar a lei de Beer-Lambert,
explorar e procurar entender o
seu significado. Isto é importante porque vai nos ajudar a entender melhor o principio de funcionamento dos
diversos analisadores contínuos do processo que utilizam a Espectroscopia como
técnica de medição.
A=ebc
Onde A é absorvância (no unidades, sendo A =
log10 P0 / P ) sendo;
e é a absorvidade molar em unidades b é o comprimento do percurso da amostra, isto é o comprimento do trajeto na célula, em que a amostra esteja contida L mol-1 cm-1
e é a absorvidade molar em unidades b é o comprimento do percurso da amostra, isto é o comprimento do trajeto na célula, em que a amostra esteja contida L mol-1 cm-1
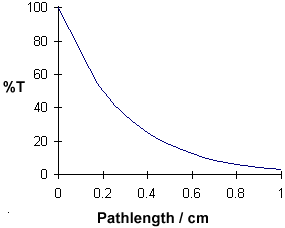
Agora,
vamos supor que temos uma solução de sulfato de cobre (que aparece azul pois
tem um máximo de absorção a 600 nm). Analisamos a maneira na qual a intensidade
da luz (potência radiante) muda à medida que passa através da solução numa
célula de 1 cm. Vamos olhar para a redução a cada 0,2 centímetros, como
mostrado no diagrama abaixo.
Para
nosso exemplo, vamos supor que esta fração é de 0,5 para cada 0,2 centímetros "layer"
e calcular os seguintes dados:
A relação
linear entre concentração e absorvância
é ao mesmo tempo simples e de fácil compreensão e é por isto que se prefere
expressar a lei de Lambert Beer, utilizando a absorvância como uma medição de
absorção % T.
Para facilitar o entendimento, o resultado gráfico de
uma técnica espectroscópica seja ela qual for é que se obtenha como resposta
uma função do comprimento de onda - ou mais comumente a frequência chamado de espectro.
Sua
impressão gráfica pode ser chamada espectrograma ou, por comodidade,
simplesmente espectro; ou largura de linha
espectral.
No
inicio o termo “espectropia” designava o estudo da interação entre radiação e matéria como uma função do comprimento
de onda (λ). De fato, historicamente,
espectroscopia referia-se a ao uso de luz visível dispersa de acordo com seu comprimento de
onda, e.g. por um prisma.
Após
um período o conceito foi expandido para compreender qualquer medida de uma
grandeza como função tanto de comprimento de onda ou frequência. Assim, este termo também pode se referir a uma resposta a um campo
alternado ou freqüência variável (ν).
Uma
posterior extensão do escopo da definição adicionou energia (E)
como uma
variável, quando obtido o relacionamento
próximo expresso por E = hν
para fótons (h
é a constante de Planck)
Espectrometro por Infra-Vermelho
I n t r o d u ç ã o
A luz de nossos olhos vêem é apenas uma pequena parte de um amplo espectro de radiação eletro magnética. No lado imediato de alta energia do espectro visível, encontra-se a radiação ultra violeta e no lado de baixa energia representa a radiação do infra vermelho. A faixa da região do infra vermelho mais úteis para a análise de compostos orgânicos e que não é imediatamente adjacente ao espectro visível, é aquela que tem uma gama de comprimento de onda entre 2.500 a 16.000 nm, com uma gama de frequências correspondente de 1,9 * 1013-1,2 * 1014 Hz.
Photon é a energia associada a parte do infra vermelho (de 1 a 15 Kcal / mol) que não são suficientemente grandes para excitar elétrons, mas pode induzir a excitação de vibração e de grupos de átomos ligados covalentemente. As ligações covalentes em moléculas não são como barras rígidas, como a encontrada em kits de modelos moleculares, mas são mais pareocidas com molas mais duras que podem ser esticados e dobrados.
Assim, praticamente todos os compostos orgânicos que absorvem a radiação infra vermelho e que corresponde, em energia para estas vibrações. Espectrómetros de infra vermelhos, semelhante, em princípio, para o espectrómetro de UV-Visível descrito em outro lugar, permitem que os químicos possam obter espectros de absorção de compostos que são um reflexo única de sua estrutura molecular. Um exemplo de tal espectro é por exemplo o agente aromatizante vanilina, mostrada abaixo no espectograma abaixo.
A escala de frequência, na parte inferior do gráfico é dado em unidades de centímetros recíprocos (cm-1) em vez de Hz, porque os números são mais manejável. O centímetros recíprocos é o número de ciclos de onda por um centímetro, e que, a frequência em ciclos por segundo ou Hz é igual ao número de ciclos de onda em 3 * 1010 centímetros (a distância percorrida pela luz em um segundo). Unidades de comprimento de onda estão em micrômetros, mícron (μ), em vez de nanômetros, pela mesma razão. Os espectros de infra vermelho são apresentados em uma escala de frequência linear, como mostrado aqui, mas em alguns textos antigos uma escala linear de comprimento de onda é utilizado.
Os espectros de infra vermelhos podem ser obtidos a partir de amostras em todas as fases (líquida, sólida e gasosa). Os líquidos são geralmente examinados como fosse um filme fino prensado entre duas placas de sal polida (notar que o vidro absorve a radiação infra vermelha, enquanto que é transparente de NaCl). Se solventes são usados para dissolver os sólidos, deve ser tomado cuidado para evitar obscurecer regiões espectrais importantes pelo solvente de absorção. Solventes tais como o tetracloreto de carbono, clorofórmio, tetracloroetano são comumente usados. Alternativamente, os sólidos podem ser incorporados em qualquer um disco KBr fina, preparado sob alta pressão, ou em mistura com um pouco de líquido não volátil e moída para dar uma pasta (ou suspensão) que está espalhado entre as placas de sal.
Espectroscopia Vibracional
A molécula composta de n-átomos tem 3n graus de liberdade, seis dos quais são traduções e as rotações da própria molécula. Isto deixa-3n-6 graus de liberdade vibracional (3n-5 se a molécula é linear). Modos de vibração são muitas vezes recebem nomes descritivos, como alongamento, flexão, tesoura, balançando e torcer. A molécula de quatro átomos de formaldeído, o espectro da fase gasosa que é mostrada abaixo, fornece uma lista destas condições. Esperamos seis vibrações fundamentais (12 menos 6), e estes foram designados para as absorções do espectro. Para ver a molécula de formaldeído exibir uma vibração, clique em um dos botões sob o espectro, ou clique em um dos picos de absorção no espectro.
A freqüência exata para que uma determinada vibração ocorre é determinado pelas forças dos títulos envolvidos e a massa dos átomos componentes. Para uma discussão mais detalhada desses fatores. Na prática, os espectros infra vermelho normalmente não exibir sinais de absorção diferentes para cada um dos 3n-6 modos vibracionais fundamentais de uma molécula. O número de absorções observadas podem ser aumentadas de aditivo e subtrativo interações levam à combinação de tons e tons fundamentais das vibrações, em muito da mesma maneira que as vibrações do som de um instrumento musical de interagir. Além disso, o número de absorções observadas podem ser diminuídas por simetria molecular, as limitações do espectrómetro, e regras de seleção espectroscópicos.
Uma regra de seleção que influencia a intensidade de absorção de infra vermelhos, é que uma mudança no momento de dipolo deve ocorrer para uma vibração para absorver a energia do infra vermelho. Bandas de absorção associadas à ligação C = O alongamento são geralmente muito forte porque uma grande mudança no dipolo ocorre nesse modo.
Algumas tendências gerais:
As regiões gerais do espectro infra vermelho e no qual vários tipos de bandas vibracionais são observados estão descritos no seguinte quadro. Note-se que as secções de cor azul acima a linha a tracejado referem-se a vibrações de estiramento, e a banda de cor verde abaixo da linha de dobragem engloba vibrações. A complexidade dos espectros de infra vermelho no 1450-600 cm-1 região torna difícil atribuir a todas as bandas de absorção, e por causa dos padrões originais encontram, é freqüentemente chamado a região de impressão digital. Bandas de absorção em 4000 para a CM-1450 é uma região geralmente devido a vibrações de estiramento de unidades diatômicas, e isto é por vezes chamada a região de frequência grupo.
Grupo de Frequências
Informações detalhadas sobre as absorções de infra vermelho observadas por vários átomos e grupos ligados geralmente é apresentado em forma tabular. A tabela a seguir fornece uma coleção de tais dados para os grupos funcionais mais comuns.
Seguindo o esquema de cores do gráfico, alongamento absorções estão listados na seção azul-shaded e absorções de flexão na parte sombreada verde.
Descrições mais detalhadas para certos grupos (por exemplo, alcenos, Arenas, álcoois, aminas e compostos de carbonila) pode ser vista clicando no nome da classe funcional.
Uma vez que a maioria dos compostos orgânicos têm ligações CH, regra útil é que a absorção no 2850-3000 cm-1 é devido ao estiramento CH sp3, e que, de absorção acima de 3000 cm-1 é de estiramento CH sp2 ou estiramento CH se ele está próximo 3300 centímetros-1.
Para ilustrar a utilidade dos espectros de absorção de infra vermelhos, são apresentados exemplos de cinco isômeros C4H8O abaixo das suas fórmulas estruturais correspondentes. Os cinco espectros podem ser examinados, por sua vez, clicando no botão "Alternar Spectra". Tente associar cada espectro (A - E), com um dos isômeros na linha acima. Quando você tiver feito atribuições conferir suas respostas clicando sobre a estrutura ou o nome de cada isômero.
Espectrometro por Ultra-Violeta
O comprimento de onda da luz visível e ultra violeta
são substancialmente
o comprimento de onda da radiação
infra vermelha. O espectro UV
está situada entre 100 nm e 400 nm.
A UV-Visspectrophotometer mede a quantidade de luz absorvida em cada comprimento de onda das regiões UV e visível do espectro electro magnético. Um espectrofotômetro UV ou visível tem o mesmo design básico como um espectrofotômetro de infra vermelho.
Em um UV Visspectrophotometer padrão, o feixe de luz é dividido; metade do feixe (o feixe de amostra) é dirigido através de uma célula transparente que contém uma solução do composto a ser analisado, e um meio (o feixe de referência) é dirigido através uma célula idêntica que não contém o composto, mas contém o solvente.
Os solventes são escolhidos para ser transparente na região do espectro a ser utilizado para a análise.
O analisador foi projetado para que ele possa fazer uma comparação das intensidades dos dois feixes, uma vez que varre todo o região abrangendo os comprimentos de onda.
A UV-Visspectrophotometer mede a quantidade de luz absorvida em cada comprimento de onda das regiões UV e visível do espectro electro magnético. Um espectrofotômetro UV ou visível tem o mesmo design básico como um espectrofotômetro de infra vermelho.
Em um UV Visspectrophotometer padrão, o feixe de luz é dividido; metade do feixe (o feixe de amostra) é dirigido através de uma célula transparente que contém uma solução do composto a ser analisado, e um meio (o feixe de referência) é dirigido através uma célula idêntica que não contém o composto, mas contém o solvente.
Os solventes são escolhidos para ser transparente na região do espectro a ser utilizado para a análise.
O analisador foi projetado para que ele possa fazer uma comparação das intensidades dos dois feixes, uma vez que varre todo o região abrangendo os comprimentos de onda.
Se o composto absorve luz com um determinado comprimento de onda, a intensidade do feixe de amostra (IS) vai ser menor do que a
do feixe de referência (RI).
A absorção de radiação de uma amostra é medido em vários comprimentos de onda
e representado por um gravador para se obter o espectro, que é uma representação gráfica
do comprimento de onda de toda a região
contra a absorção (A) da luz em cada comprimento de onda (nm).
O espectro mostra uma variação de 200-400 nm. Como a
absorção de dióxido de carbono
atmosférico torna-se significativo abaixo de 200 nm, na região de 100-200 nm o geralmente não é verificado a menos que sejam empregadas técnicas ar livre
especiais.
O comprimento de onda de absorção é normalmente classificado como λmaxwhich representa o comprimento de onda no ponto mais alto do curve.
O comprimento de onda de absorção é normalmente classificado como λmaxwhich representa o comprimento de onda no ponto mais alto do curve.
A absorção de
energia é avaliado como absorvância (não transmitância
como em espectros no infra vermelho)
A absorvância a um
comprimento de onda particular, é
definido pela equação descrita a seguir:
Espectroscopia On-line
UV / Vis “in situ”
Tempo de medição dos parâmetros de multi
reais com um único instrumento
As vantagens dos sensores on-line para análise da qualidade da água estão se tornando cada vez mais amplamente reconhecida. O número real de aplicações, no entanto, continua a ser bastante limitado para esta data devido às capacidades limitadas dos instrumentos disponíveis. A introdução da espectrometria de sondas multi-parâmetros, com baixa necessidade de manutenção, no entanto, está mudando a cara de monitoramento on-line de forma significativa.
As vantagens dos sensores on-line para análise da qualidade da água estão se tornando cada vez mais amplamente reconhecida. O número real de aplicações, no entanto, continua a ser bastante limitado para esta data devido às capacidades limitadas dos instrumentos disponíveis. A introdução da espectrometria de sondas multi-parâmetros, com baixa necessidade de manutenção, no entanto, está mudando a cara de monitoramento on-line de forma significativa.
Introdução
Qualidade das águas superficiais podem mudar rapidamente, por exemplo, devido ao mau tempo (chuvas) ou eventos de contaminação, como derramamentos de petróleo, run-off das atividades de combate a incêndio, etc A detecção rápida dos contaminantes é importante para auxiliar na mitigação de possíveis efeitos negativos sobre o ambiente e a saúde humana. Monitoramento on-line da qualidade da água real, e não apenas os dados hidrológicos, fornece as informações necessárias para o reconhecimento oportuno de mudanças. Além disso, o monitoramento on-line pode fornecer uma riqueza de dados sobre a dinâmica natural dos sistemas de água, que é impossível de obter usando amostragem grab, que fornece uma imagem muito melhor das verdadeiras mudanças na qualidade da água, enquanto que amostras de agarrar fornecer apenas instantâneos de um pequeno número de momentos no tempo.
Qualidade das águas superficiais podem mudar rapidamente, por exemplo, devido ao mau tempo (chuvas) ou eventos de contaminação, como derramamentos de petróleo, run-off das atividades de combate a incêndio, etc A detecção rápida dos contaminantes é importante para auxiliar na mitigação de possíveis efeitos negativos sobre o ambiente e a saúde humana. Monitoramento on-line da qualidade da água real, e não apenas os dados hidrológicos, fornece as informações necessárias para o reconhecimento oportuno de mudanças. Além disso, o monitoramento on-line pode fornecer uma riqueza de dados sobre a dinâmica natural dos sistemas de água, que é impossível de obter usando amostragem grab, que fornece uma imagem muito melhor das verdadeiras mudanças na qualidade da água, enquanto que amostras de agarrar fornecer apenas instantâneos de um pequeno número de momentos no tempo.
Portanto, o uso de analisadores por
espectrometria on-line é cada vez mais
vista como um grande benefício o qual proporciona (quase) informação contínua sem
perder nenhuma mudança de qualidade. Estas
vantagens têm sido reconhecidos, bem como no tratamento de águas e águas
residuais, em que as alterações de concentração e / ou a composição da água de entrada
pode ser detectada e, por conseguinte, uma eventual falha do desempenho estação
de tratamento pode ser evitado. Além disso, o monitoramento da água potável, ou
na fonte ou no sistema de distribuição, permite a identificação de baixa
probabilidade / eventos de alto impacto, que possam comprometer a qualidade da
água e, como conseqüência saúde pública.
A identificação precoce é o pré-requisito para uma resposta eficaz que reduz ou impede totalmente o impacto negativo de tal contaminação. Espectroscopia de UV / Vis é uma ferramenta que está bem adaptada para realizar estes tipos de controle.
A identificação precoce é o pré-requisito para uma resposta eficaz que reduz ou impede totalmente o impacto negativo de tal contaminação. Espectroscopia de UV / Vis é uma ferramenta que está bem adaptada para realizar estes tipos de controle.
Espectroscopia UV/Vis
O uso de espectroscopia UV
/ Vis em química analítica
remonta aos anos 1950 e 1960. Foi, no entanto, inicialmente associado com equipamento de laboratório
grande e caro. Na década de 1980,
a introdução de detectores de arranjo de
diodos em miniatura, juntamente com micro processadores poderosos e ferramentas matemáticas state-of-the-art, levou a um renascimento da espectroscopia UV / Vis e viu a introdução do compacto, de custo relativamente baixo e ainda assim
poderoso UV laboratório
/ máquinas Vis.
No entanto, o mercado para os sensores
ópticos / sondas in
situ ainda era - e ainda é - dominado por fotômetros
relativamente simples que são capazes de medir apenas um ou dois comprimentos de onda de cada vez. Assim, estes instrumentos estão limitados a
medir apenas um parâmetro, e na melhor das hipóteses empregar métodos bastante bruto e instável para
compensar sensibilidades cruzadas
a variações, por exemplo, numa matriz de água. Exemplos
de aplicações utilizadas desses
instrumentos de comprimento de onda único no monitoramento da
qualidade da água são a medida de
nitrato, turbidez e orgânicos (indicado
como SAC254, coeficiente de absorção espectral
em 254 nm). Sensibilidade
reduzida transversal, bem como uma
riqueza de informação adicional, pode
ser obtido quando utilizando a
totalidade do espectro de absorção de comprimentos de onda, em vez de simples.
A evolução da eletrônica e óptica ao longo dos últimos anos têm permitido o
casamento entre espectro UV /
Vis e instrumentos robustos, de pequena escala.
A sonda do espectrômetro
A medição é realizada “in situ”, sem amostragem
ou a amostra de pré-tratamento,
evitando erros devido a manipulação da amostra,
tais como transporte e
o armazenamento da amostra, etc Um ciclo
de medição leva entre 20 e 60
segundos, possibilita uma elevada frequência de medição e detecção de rápido mudanças.
Para uma estabilidade de longo prazo do sinal produzido,
um cartão de
divisão do feixe de luz é utilizada, um feixe passa através da amostra, enquanto que os outros
viajam ao longo de um caminho paralelo no interior do aparelho e, assim, atua como uma
referência interna. Esse segundo feixe
é usada para cancelar as
flutuações na energia fonte de
luz e variações instrumentais,
devido às condições ambientais.
Os instrumentos estão disponíveis com diferentes comprimentos
do compartimento de medição,
abrindo-se uma vasta gama de aplicações,
de água ultra-pura (orgânicos
dissolvidos no intervalo ug / L) até águas residuais concentrados (materiais
orgânicos e não-dissolvido em dezenas de gramas / L
range). Porque nem
química nem partes que se deslocam para a limpeza são necessárias para o seu funcionamento,
um sistema de limpeza com ar pressurizado
é utilizado, o espectrómetro
pode funcionar em ambientes agressivos,
com pouca ou nenhuma manutenção.
O princípio de medição
Os espectros de absorção, referido como as impressões digitais,
obtidos através de espectrómetros em linha são utilizados para a caracterização da água amostrada. Dentro destas impressões digitais pode-se encontrar uma enorme quantidade de
informações sobre a composição da água,
são utilizados calcular parâmetros
específicos, tais como turbidez, concentração
de nitrato, e os parâmetros como
a soma SAC254, DQO, TOC e DOC.1
Turbidez devido a substâncias suspensas provoca espalhamento de luz e sombras, influenciando, assim, a absorção em toda a impressão digital. Este é um fator importante que influencia a medições in situ e de compensação requer, a fim de obter leituras confiáveis e reproduzíveis.
A compensação turbidez desenvolvido avalia parte do espectro original e, em seguida, calcula uma função que descreve a turbidez. Esta função é usada para compensar o espectro da turbidez e para a determinação do nível de turbidez si / sólidos suspensos totais (SST).
Turbidez devido a substâncias suspensas provoca espalhamento de luz e sombras, influenciando, assim, a absorção em toda a impressão digital. Este é um fator importante que influencia a medições in situ e de compensação requer, a fim de obter leituras confiáveis e reproduzíveis.
A compensação turbidez desenvolvido avalia parte do espectro original e, em seguida, calcula uma função que descreve a turbidez. Esta função é usada para compensar o espectro da turbidez e para a determinação do nível de turbidez si / sólidos suspensos totais (SST).
A partir da impressão digital compensados os níveis de compostos dissolvidos pode então ser
determinado, ou como os parâmetros de soma tais como DOC
ou cor, ou como substâncias individuais, tais como
o benzeno ou o ozono. As últimas aplicações usa
o reconhecimento da forma dos perfis de absorção características destas substâncias para assegurar um mínimo de sensibilidade
cruzada com
outras espécies de absorção de UV
Uma
aplicação muito eficaz de espectrômetros on-line e os algoritmos espectrais
desenvolvidos é a na analise de TOC/DOC ou COD/BOD (DBO Demanda Bioquimica de
Oxigênio. Os analisadores clássicos para se aplicar estes parâmetros, requerem
muita manutenção. A substituição por espectrometro elimina este inconvenientes
e ao mesmo tempo aumenta a disponibilidade dos resultados de medição e alcança
uma precisão que é de cerca de uma ordem de magnitude melhor do que o padrão
DOC analysers3.
Por exemplo, observou-se um período
diário dos orgânicos e
concentrações de amônio , como resultado dos ciclos diários da composição
do efluente final de estações de
tratamento de águas residuais localizadas
a montante do local de medição.Nesta
aplicação particular, os resultados do sistema de monitorização são transmitidos
através de GSM para uma base de
dados central de recolha de
resultados de várias estações de
monitorização. Esta base de dados central também oferece a visualização dos resultados obtidos através da internet e, como tal, está
acessível em todo o mundo. Além
disso, por causa dos níveis de
água fortemente flutuantes no
Danúbio, o sistema foi montado sobre
um carrinho, para que a instalação
é completamente ajustável para o nível real.
Atualmente a utilização de analisadores tipo On-line
UV/Vis esta aumentando consideravelmente
o seu uso tanto na monitoração como no controle das estações de tratamento de
efluentes.
Os espectrometros on-line são utilizados nas
estações de tratamento de efluente para determinar a carga de material orgânico
(COD), nitrato e sólidos em suspensão (TSS). Monitoração de efluentes auxiliam
as estações de tratamento de efluente a manter a descarga da agua dentro dos
padrões ambientais exigidos.
Também permite a avaliação da eficiência de todo o processo de tratamento. Além disso,
espectrômetros são aplicados para
controlar os passos específicos no
processo de tratamento, o mais notável o processo de
arejamento. Durante aeração
compostos nitrogenados são oxidados
para nitrato (nitrificação). No caso de conversão incompleta, no
entanto, o nitrito é formada, que é
altamente tóxico para os organismos aquáticos.
O controle dos níveis de nitrato e nitrito em que o
processo pode ser usado para
assegurar a conversão máxima. Em
comparação com os horários fixos
normalmente utilizadas para orientar este processo, a espectroscopia em
linha permite direção do processo de tal modo que o tempo utilizado para cada passo é reduzido para o
que está realmente necessária,
pois o progresso em diferentes etapas, isto é, nitrificação, desnitrificação e fixação, podem ser monitoradas.
Isto permite a maximização do volume de água que pode ser tratada. Além
disso, o aumento da eficiência do processo de aeração, muitas vezes faz com que o período de amortização para o investimento em instrumentos seja muito curto.
Monitoração de vazamentos industriais
A principal aplicação da espectroscopia em linha na indústria pode ser encontrada no controle de instalações de tratamento
de águas residuais. Uma segunda aplicação,
é a detecção de vazamento
de produtos. Um exemplo desta aplicação esta ligada ao alarme de
vazamento de hidro carbonetos em uma indústria petroquímica que
esteja contaminando o efluente liquido. Espectrómetros
também são utilizados, por exemplo, para
monitorizar as concentrações de hidro carbonetos totais e benzeno para níveis abaixo de 10 ppb.
n
Um terceiro exemplo de aplicação é a utilização do
espectrómetro em linha para
perfilar a propagação de contaminantes nas águas subterrâneas, em zonas industriais, através
da inserção de sondas nos furos e as
analises das concentrações em
várias profundidades no lençol freático. subterrânea.
As
características avançadas de espectrometria
por on-line
As sondas do espectrômetro
podem gravar todo o espectro e até recursos mais avançados do que medir parâmetros
clássicos são possíveis. O
desenvolvimento de novas variáveis, chamados parâmetros de alarme, que permitem uma avaliação geral das alterações na qualidade da água, é possível. Tais parâmetros
de alarme pode ser visto como parâmetros
alternativos, que monitorizam as
partes do espectro para os desvios a partir da sua forma normal conhecido.
Este
tipo de reconhecimento de formas é
uma estratégia útil para detectar alterações que não vai ser identificada na
forma convencional, único contaminante. Apenas alterações
devido a fenômenos naturais extremos
e alterações antropogénicas são tipicamente muito mais rápidas do que
aquelas que ocorrem gradualmente devido a mudanças naturais, tais
como mudanças sazonais, é possível
identificar as composições de
água incomuns unicamente com base mudanças espectrais ao longo do tempo.
Estas aplicações de alarme estão sendo aplicadas para monitorar tanto a água do rio como a água potável em todo o mundo. Espectrometria de UV / Vis on-line provou ser uma ferramenta altamente capazes para monitorizar a qualidade da água em tempo real em laboratório e diretamente no campo.
Usando um único
instrumento, é possível medir vários
parâmetros on-line e em vários tipos de líquidos, o que é uma característica única entre os sistemas de sensores online. Como a tecnologia avança e mais experiência é recolhida, uma ainda mais a
ampliação de aplicações e um aumento do número de parâmetros que podem ser medidos utilizando
esta técnica.
Espectrometro de Massa
Espectrometro Online Thermo modelo PrimaPro
As três funções essenciais de um espectrómetro de
massa, e os componentes associados, são:
1. Uma pequena amostra é ionizada, geralmente para cátions pela
perda de um elétron. O Ion Fonte
2. Os íons são classificados e separados de acordo com sua massa
e carga. O analisador de massa.
3. Os íons separados são então medidos, e os resultados
apresentados no gráfico. O Detector
Como os íons são muito reativos e de curta duração,
a sua formação e manipulação devem ser realizados no vácuo. A pressão
atmosférica é de cerca de 760 Torr (mm de mercúrio). A pressão sob a qual os
íons podem ser tratadas é aproximadamente 10-5 a 10-8 Torr (menos do que uma
milionésima parte de uma atmosfera).
Cada uma das três funções listadas acima podem ser
realizadas de diferentes maneiras. Em um procedimento comum, a ionização é
efetuada por um feixe de electrões de alta energia, e de separação de íons é
alcançado através da aceleração e focando os íons de um feixe, o qual é então
dobrado por um campo magnético externo.
Os íons são, então, detectados eletronicamente e a
informação resultante é armazenado e analisado num computador. Um espectrômetro
de massa operacional dessa forma é descrito no diagrama seguinte.O coração do espectrometro de massa é a fonte de íons. Aqui as moléculas da amostra (pontos pretos) são bombardeados por elétrons (linha azul claro) a emissão de um filamento aquecido. Isso é chamado de (elétron-impact) fonte EI.

São permitidas tanto amostras de gases como líquidos voláteis para dentro da fonte de íons a partir de um reservatório (conforme diagrama acima). Sólidos e líquidos não-voláteis podem ser introduzidos diretamente. Os cátions formados pelo bombardeio de elétrons (pontos vermelhos) sendo empurrados para longe por um eletrodo repellor (ânions são atraídos para este dispositivo ), e acelera em direção a outros eletrodos, com fendas através das quais os íons trafegam. Alguns fragmento destes íons e cátions menores e também fragmentos neutros. Um campo magnético perpendicular deflete o feixe de íons em forma de arco, cujo raio é inversamente proporcional à massa de cada íon. Os íons mais leves são desviados mais do que os íons mais pesados. Através da variação da intensidade do campo magnético, os íons de massa diferente podem ser focados de forma progressiva, o detector fixo é montado na extremidade de um tubo curvo (também sob um alto vácuo).
A seguir abordamos a teoria que envolve este principio e quando um elétron carregado de alta energia colide com uma molécula é ionizado batendo longe um dos elétrons moleculares (ou de ligação ou não ligação). Deixando para trás um íon molecular (cor vermelha ).
Energia
residual da colisão pode fazer com que o íon molecular se fragmente em partes neutras (cor verde) e íons fragmentados
menores (cor-de-rosa e laranja). O íon molecular é um cation radical, mas
os
íons de fragmento podem ser tanto cations radicais (rosa) ou Carbocations
(laranja), dependendo da natureza do fragmento neutro.
O espectro de massa será geralmente apresentado como um gráfico de barras verticais, em que cada barra representa um íon com uma razão de massa-para-carga específica (m / z) e o comprimento da barra indica a abundância relativa de o íon. O íon mais intenso é atribuído em uma abundância de 100, e é referido como o pico de base. A maioria dos íons formados num espectrómetro de massa tem uma única carga, de modo que o valor de m / z é equivalente à massa em si.
Espectrômetros de massa modernos, conseguem facilmente distinguir (identificar) os íons diferentes por uma única unidade de massa atômica, e, assim, fornecer valores completamente precisos para a massa molecular de um composto. O íon maior em massa num espectro é normalmente considerado o íon molecular, e os íons de menor massa são fragmentos a partir do íon molecular, assumindo que a amostra é um único composto puro.
Massa atômica é dada em termos da unidade de massa atômica (símbolo: μ) ou dalton (símbolo: Da). Nos últimos anos, tem havido uma mudança gradual para a utilização do dalton, de preferência a unidade de massa atômica.
O dalton é classificado como uma "unidade de não-SI cujos valores em unidades SI devem ser obtidos experimentalmente." É definido como um doze avos da massa restante de um átomo de carbono não ligado -12 no seu estado terreno nuclear e eletrónicos, e tem um valor de 1,660538782 (83) x10-27 kg. O diagrama a seguir mostra o espectro de massa de três compostos simples gasosos, dióxido de carbono, propano e ciclo propano.
As moléculas desses compostos são semelhantes em tamanho, CO2 e C3H8 ambos têm uma massa nominal de 44 Da, C3H6 e tem uma massa de 42 Da. O ião molecular é o ião forte nos espectros de CO2 e C3H6, e é moderadamente forte em propano. A massa de unidade de resolução é prontamente aparente nestes espectros (notar a separação de iões com m / z = 39, 40, 41 e 42 no espectro de ciclo propano). Mesmo que estes compostos são muito semelhantes em tamanho, é uma questão simples para identificá-los a partir de seus espectros de massa individual.
Ao clicar em cada espectro, por sua vez, uma análise de fragmentação parcial e pico a atribuição será exibida. Mesmo em compostos simples como estes, deve notar-se que é raramente possível explicar a origem de todos os íons de fragmento em um espectro. Além disso, a estrutura da maioria dos íons fragmentados raramente é conhecido com certeza.
Uma vez que uma molécula de dióxido de carbono é composta de apenas três átomos, o seu espectro de massa é muito simples. O ião molecular é também o pico de base, e apenas os iões fragmentados são CO (m / z = 28) e O (m / z = 16). O ião molecular de propano tem também m / z = 44, mas não é o íon mais abundante no espectro. A clivagem de uma ligação carbono-carbono dá fragmentos de metilo e de etilo, um dos quais é um carbocation e o outro um radical. Ambas as distribuições são observados, mas o cation acetato maior (m / z = 29) é o mais abundante, possivelmente por causa de seu tamanho permite maior dispersão de carga.
Compostos orgânicos mais estáveis têm um número par de elétrons totais, refletindo o fato de que os elétrons ocupam orbitais atômicas e moleculares em pares. Quando um único eletron é removido a partir de uma molécula para dar um íon, a contagem total de eletrons torna-se um número ímpar, e referem-se a tais íons cations radicais. O íon molecular no espectro de massa é sempre um cation radical, mas os íons de fragmento pode ser tanto cations mesmo eletrons ou cations radicais ímpar de eletrons, dependendo do fragmento neutro perdido. As fragmentações mais simples e mais comum são as clivagens títulos produzindo uma (número ímpar de elétrons) radical neutro e um cátion ter um número par de elétrons. A fragmentação menos comum, em que um fragmento neutro mesmo elétron é perdido, produz um íon fragmento cátion radical ímpar de elétrons. Íons fragmento pode-se fragmentar ainda mais.
Como regra geral, os íons ímpar de elétrons podem fragmentar ou a íons ímpares ou pares de elétrons, mas fragmentos de íons pares de elétrons apenas para outros íons pares de elétrons. As massas dos íons moleculares e fragmento refletem também a contagem de electrons, dependendo do número de átomos de azoto nas espécies.
Esta distinção é muito bem ilustrada por dois exemplos a seguir; a acetona etilo insaturada, de 4-metil-3-penteno-2-ona, à esquerda não tem azoto de modo a massa do íon molecular (m / z = 98) é um número par. A maioria dos íons fragmentado tem ímpares massas, e, portanto, são cátions pares de elétrons. Dietilmetilamina, por outro lado, tem um átomo de azoto e a sua massa molecular (m / z = 87) é um número impar. A maioria dos íons de fragmento têm massas de numeração par (íons a m / z = 30, 42, 56 e 58 não são rotulados), e até mesmo azoto são cations de elétrons. Os íons fracos de elétrons, mesmo a m / z = 15 e 29 são devidas a metilo e cations de (nenhum átomo de azoto).
Quando os pares de elétrons não-ligados pares estão presentes numa molécula (por exemplo, em N ou O), caminhos de fragmentação pode por vezes ser explicado assumindo que o eletron é parcialmente ausente localizado em que átomo. Alguns destes mecanismos são mostrados acima. Clivagem de ligação gera um radical e um cátion, e ambos os fragmentos, muitas vezes compartilham essas funções, embora de forma desigual.
3. Isotopos
Uma vez que um espectrômetro de massa separa e detecta íons de massas ligeiramente diferentes, facilmente distingue diferentes isótopos de um determinado elemento. Isto manifesta-se mais dramaticamente para compostos contendo cloro e bromo, tal como ilustrado pelos exemplos seguintes.
Como as moléculas de bromo tem apenas dois átomos, o espectro de esquerda virá como uma surpresa se uma única massa atômica de 80 Da é assumida por Br. Os cinco picos nesse conjunto demonstram claramente que o bromo natural é formada por uma mistura de cerca de 50:50 de isótopos com massas atômicas de 79 e 81, Da respectivamente.
Assim sendo, a molécula de bromo pode ser composta por dois átomos 79Br massa (158 Da), 81Br dois átomos de massa (162 Da) ou a combinação mais provável de 79Br, 81Br (massa de 160 Da). Fragmentação de Br2 para um cation de bromo dá então origem a picos de íons com as mesmas dimensões de 79 e 81 Da.
A fragmentação de íons moleculares em uma variedade de íons fragmentados podemos comentar que é uma faca de dois gumes. A natureza dos fragmentos geralmente fornece uma pista para a estrutura molecular, mas se o íons molecular tem uma duração menor do que uns poucos microssegundos não irão sobreviver o tempo suficiente para ser observado. Sem um pico de íon molecular, como uma referência, a dificuldade de interpretação de um espectro de massa aumenta acentuadamente.
Porém, a maioria dos compostos orgânicos proporciona espectros de massa que incluem um íon molecular, e aqueles que não costumam responder com sucesso para a utilização de condições mais suaves de ionização.
Entre os compostos orgânicos simples, os íons moleculares mais estáveis são aquelas a partir de anéis aromáticos, outros sistemas de electrons pi-conjugados e ciclo alcanos.
Álcoois, éteres e alcanos altamente ramificados geralmente apresentam a maior tendência para a
fragmentação . O espectro de massa de dodecano à direita ilustra o comportamento de um alcano ramificado. omo não há hetero-átomos na molécula, não ocorre a não-ligação elétrons da camada de valência.
Por conseguinte, o carácter cation radical do íon molecular (m / z = 170) está deslocado sobre todas as ligações covalentes. Fragmentação de ligações CC ocorre porque são geralmente mais fraca do que ligações CH, e isso produz uma mistura de radicais alquilo e Carbocations alquilo.
A carga positiva geralmente reside no menor fragmento, portanto, ver uma série homóloga de hexilo (m / z = 85), pentilo (m / z = 71), butilo (m / z = 57), propilo (m / z = 43), de etilo (m / z = 29) e metil (m / z = 15) catiões.
Estes são acompanhadas por um conjunto de carbocations alcenilo correspondentes (por exemplo, m / z = 55, 41 & 27) formado por perda de 2 H. Todos os íons fragmento significativos neste espectro são íons mesmo elétrons.
Na maioria dos espectros de alcano os íons de propilo e butilo são os mais abundantes. A presença de um grupo funcional, em particular um tendo um heteroátomo Y não-ligados com elétrons de valência (Y = N, O, S, X, etc), pode alterar drasticamente a fragmentação.
Analisador (Espectrometro de RAMAN)
A espectroscopia Raman é uma técnica fotônica de alta resolução que pode proporcionar, em poucos segundos, informação química e estrutural de praticamente qualquer material, sendo composto orgânico ou inorgânico e por este principio permitindo a sua identificação.
Chandrasekhara Venkata Raman, físico indiano que recebeu no ano de 1930 o
Premio Nobel de Física pelos trabalhos sobre o espalhamento da luz e a
descoberta do Efeito Raman. Em 1957 foi-lhe atribuído o Prêmio Lênin da Paz.
A mudança no comprimento de onda de luz dispersa, durante a passagem através de um meio transparente, a recolha de novos comprimentos de onda (espectro de Raman), sendo característica o meio de dispersão e diferindo do espectro fluorescente por ser muito menos intenso.
I n t r o d u ç ã o
As principais técnicas espectroscopicas
aplicadas para detectar as vibrações
nas moléculas são baseadas nos processos de absorção de Infra vermelhos e
Raman. Elas são amplamente utilizados
para fornecer a informação sobre as estruturas químicas e as formas físicas, para
identificar substâncias provenientes dos padrões espectrais característicos ("impressão digital"),
e para a determinação quantitativa
ou semi-quantitativa da quantidade de
uma substância numa amostra. As amostras podem ser examinadas em toda uma gama de estados físicos, por
exemplo, na forma de sólidos, líquidos ou vapores, em estados quentes
ou frias, em grandes quantidades,
na forma de partículas microscópicas,
ou como camadas superficiais.
As técnicas são muito amplos e fornecer soluções para uma série de interessantes e desafiadores
problemas analíticos. Espalhamento Raman
é menos usado do
que a absorção de infra vermelho,
em grande parte devido a problemas com
a degradação da amostra e de fluorescência. No entanto, avanços recentes na tecnologia do instrumento tem simplificado o equipamento e reduz substancialmente
os problemas.
Estes avanços, juntamente com a
capacidade de espectroscopia de
Raman para examinar soluções aquosas, as amostras dentro de
recipientes de vidro e as amostras
sem qualquer preparação, têm levado a um rápido crescimento
doaplicação da técnica.
Na prática, a espectroscopia Raman
moderna é simples. Parâmetros do instrumento variáveis são
poucos, manipulação espectral é mínima e uma simples interpretação dos dados pode ser suficiente. para estabelecer
os princípios básicos e métodos experimentais para dar ao leitor uma compreensão sólida da teoria básica
e considerações práticas para que a técnica pode ser aplicada em nível muitas vezes necessário
para aplicações atuais.
No entanto, espalhamento Raman é uma técnica desenvolvida, com muita informação importante, muitas vezes não utilizado ou reconhecido. Posteriormente capítulos irá desenvolver a teoria mínima necessária para se obter uma compreensão mais detalhada dos dados obtidos e, para permitir a compreensão de algumas das muitas técnicas mais avançadas que têm vantagens específicas para algumas aplicações.
No entanto, espalhamento Raman é uma técnica desenvolvida, com muita informação importante, muitas vezes não utilizado ou reconhecido. Posteriormente capítulos irá desenvolver a teoria mínima necessária para se obter uma compreensão mais detalhada dos dados obtidos e, para permitir a compreensão de algumas das muitas técnicas mais avançadas que têm vantagens específicas para algumas aplicações.
T e o r i a B á s i c a
Quando a luz interage com a matéria, os fotons que compõem a luz pode ser
absorvida ou dispersa, ou não pode interagir com o material e pode passar diretamente
através dele. Se a energia de um foton incidente
corresponde à diferença entre a energia do
estado fundamental de uma molécula e um estado animado, o
foton pode ser absorvido e
a molécula promovida para o estado
de energia mais elevado. É esta variação que é
medido em espectroscopia de absorção, através da
detecção de que a
perda de energia de radiação da luz.
No entanto, também é possível que o foton para interagir com a molécula a partir dele e de dispersão. Neste caso, não há necessidade de que o foton para ter uma energia que corresponde a diferença entre os dois níveis de energia da molécula. Os fotons dispersos podem ser observadas através da recolha de luz em um ângulo para o feixe de luz incidente, e desde que não haja absorção de quaisquer transições eletrónicas que têm energias semelhantes às da luz incidente, a eficiência aumenta à medida que a quarta potência da frequência a luz incidente.
Dispersão é uma técnica vulgarmente utilizada.
Por exemplo, é amplamente utilizada para a medição de tamanho de partícula e distribuição de tamanho para tamanhos menores do que 1 mm. Um exemplo cotidiano desta situação é que o céu é azul porque a luz azul de energia mais elevada está espalhado a partir de moléculas e partículas na atmosfera de forma mais eficiente do que a menor luz vermelha de energia. No entanto, a técnica de espalhamento principal utilizado para a identificação molecular é Raman.
Raman não necessita de harmonização da radiação incidente para a diferença de energia entre o solo e estados excitados. Na dispersão de Raman, a luz interage com a molécula e distorce
(polariza) da nuvem de electrons em torno do núcleo de modo a formar um ciclo de vida curta.
No entanto, também é possível que o foton para interagir com a molécula a partir dele e de dispersão. Neste caso, não há necessidade de que o foton para ter uma energia que corresponde a diferença entre os dois níveis de energia da molécula. Os fotons dispersos podem ser observadas através da recolha de luz em um ângulo para o feixe de luz incidente, e desde que não haja absorção de quaisquer transições eletrónicas que têm energias semelhantes às da luz incidente, a eficiência aumenta à medida que a quarta potência da frequência a luz incidente.
Dispersão é uma técnica vulgarmente utilizada.
Por exemplo, é amplamente utilizada para a medição de tamanho de partícula e distribuição de tamanho para tamanhos menores do que 1 mm. Um exemplo cotidiano desta situação é que o céu é azul porque a luz azul de energia mais elevada está espalhado a partir de moléculas e partículas na atmosfera de forma mais eficiente do que a menor luz vermelha de energia. No entanto, a técnica de espalhamento principal utilizado para a identificação molecular é Raman.
Raman não necessita de harmonização da radiação incidente para a diferença de energia entre o solo e estados excitados. Na dispersão de Raman, a luz interage com a molécula e distorce
(polariza) da nuvem de electrons em torno do núcleo de modo a formar um ciclo de vida curta.
Principais Caracteristicas;
Espectroscopico Raman tipo “in-situ”
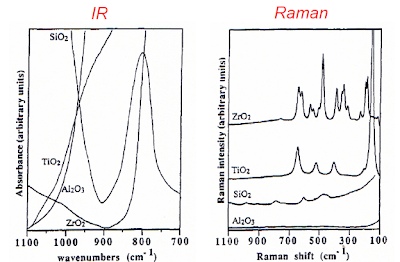
Os gráficos indicados a seguir mostram o
resultado das analises realizadas por um analisador do tipo IR (infra vermelho)
e um Espectroscopico Raman.
Os gráficos a seguir mostram o resultado das analises realizadas por um espectrômetro por IR (infra vermelho) e outro via Espetroscopico de Raman.
Espectrometro de Raman para aplicações on-line
O analisador por espalhamento Raman baseada em fibra óptica para análise em tempo real, on-line para analise gasolina e demais componentes da gasolina, além do óleo diesel, querosene de aviação e querosene.
Análise de Raman é bem adequado para mistura de gasolina por várias razões;
1. Espalhamento Raman não exige condicionamento de amostras,
2. A alta resolução os espectros de Raman da gasolina permitir que os vários componentes químicos para ser distinguida e quantificados,
3. Trabalhando na região NIR permite o acoplamento de fibras ópticas da sonda de fluxo de amostra e o analisador de Raman
4. Trabalhando com fibras ópticas permite a multiplexação muitas sondas Raman individuais para um único instrumento, reduzindo a calibragem do instrumento e simplificando a manutenção geral.
Monitoração contínua in-situ, um dos fluxos de componentes ou produtos finais podem fornecer feedback quase que instantâneo sobre as alterações importantes no processo de mistura, que podem conduzir a um controle de processo em tempo real, a melhoria da qualidade do produto acabado, a redução do custo global, e minimizados de resíduos.
Uma representação esquemática dos componentes do nosso sistema analisador de Raman é exibida. Utilizamos a nossa frequência estabilizada, laser de alta potência (Patente No. 6.100.975) por amostra de excitação, e o laser pode ser configurada para aplicações específicas para operar em qualquer lugar na gama de comprimentos de onda 640-850 nm. A saída do laser é então acoplado a uma fibra de excitação que pode ser de até 300 metros (1000 pés) de comprimento. A sonda de Raman (descrito em mais pormenor a seguir) está localizada na outra extremidade da fibra de excitação. Amostra de excitação e recolha ocorre a partir da extremidade da sonda de Raman, e o sinal de Raman é acoplado a uma fibra de recolha em que é transmitido ao nosso espectrógrafo (Patente No. 6.028.667). A detecção das frequências individuais Raman é pré-formado por meio de um sensor CCD. O nosso software PROspectTM gera as previsões de Raman do espectro adquirido e também controla a totalidade das ligações de interface de eletronica utilizados para operar o analisador de Raman. Uma vantagem com esta configuração é que apenas estão a transmitir a luz para e a partir da amostra e não utilizam qualquer energia eléctrica à sonda de amostragem e assim as sondas são intrinsecamente seguro.
O PI-200 analisador de Raman pode detectar concentrações de líquidos para o nível de 5 ppm. O instrumento também pode estar ligado a um multiplexador de fibra óptica (Patente No. 6.859.581), que pode ser configurado para rodar até 18 canais de série individuais fora um único instrumento. Um dos canais do multiplexador pode ser usado como um canal, onde o desempenho de uma amostra de referência fornece instrumentos diagnósticos em tempo real
Sonda de Raman tipo in-line
As sondas projetadas são do tipo retrátil com o objetivo de facilitar o acesso para limpeza e podem suportar pressões até (200 psi). Para aplicações em altas pressões se faz necessário acoplamentos atráves de flanges soldados que suportam pressões máximas de até 3.000 psi.
As amostras são excitadas, coletadas e conduzidas via uma janela de safira localizada na parte imersa do probe (ponta do probe) e suportam temperaturas acima de 250OC.
A sonda Raman in-line e célula de fluxo são
utilizadas para monitorar a linha de slip-stream por exemplo. A sonda de Raman é
protegida do fluxo de amostra por
uma janela de safira, que suporta pressões de até
550 psi. A sonda de alta temperatura é opcional e os projetos de célula de fluxo estão disponíveis desde temperatura de até 250
C e pressão de 3.000 psi. As taxas de fluxo típicas
são entre 20 a 50 cc / min. A célula da
amostra possui um espaço morto
mínimo e pode ser facilmente limpo,
se necessário.
Acessórios de
compressão de aço inoxidável convencionais permitem a conexão rápida com um fluxo de
amostragem convencional.
Assim como as sondas de imersão Raman da
unidade in-line esta opção também é intrinsecamente
segura e sem conexões elétricas e pode ser usado com cabos
de fibra óptica com comprimento de até
300 metros (1.000 pés) de comprimento. A sonda in-line é envolto em um
gabinete NEMA 4x 12 ou NEMA que a
protege do ambiente externo.
In-Line Flow Cell para aplicações em área classificada.